Semi-synthesis of homogeneous glycoprotein using novel expressed peptide thioesterification methods
[要約]
このページでは、SPPSを使わず、大腸菌発現法で調製した長鎖ペプチドのC末端を化学的に活性化し、ペプチドチオエステル、ペプチドヒドラジドを得る方法について述べる。
Peptide activation
N型糖鎖を用いた糖タンパク質の合成を展開してきたが、より効率的な合成には、簡便な長鎖ペプチドチオエステルの合成が必要である。そのような観点から、これまで、細胞発現(通常は大腸菌発現)と化学合成(主にSPPS)を組み合わせた糖タンパク質の半合成が開発されている。大腸菌発現では200残基以上の糖鎖を持たないペプチドを合成できる。一方、SPPSでは大腸菌では合成できない糖鎖を持つ短い糖ペプチドを合成することができる。その後、大腸菌で調製したペプチドとSPPSから得た糖ペプチドをNCLで連結することで、短い工程で標的糖タンパク質の全長糖ペプチドを得ることができる。(糖)タンパク質の半合成において、主な課題は大腸菌発現から得たペプチドのチオエステル化、すなわち発現ペプチドのチオエステル化である[35-36]。(図14)Inteinシステム[35]や組換えポリペプチドに対する特異的プロテアーゼ[37-39]などを用いたチオエステル化法があるが、これらの酵素法は特定のアミノ酸配列を必要とするため、生成物に一部の配列が残るという問題がある。また。標的タンパク質の疎水性が高い場合は、溶解性の問題が生じ、酵素法では対応できないものが多数ある。そこで、有機溶媒中や、グアニジンなどの変性剤中で実施するチオエステル化法が必要であった。 岡本らは、C末端および内部のCys修飾というユニークな戦略を用いて、組換えペプチドの化学的チオエステル化反応を開発した。2012年、彼らはシステイン残基のβ-チオール基を選択的にS-チオカルボニル化し、O-フェニルクロロチオノホルメートを用いてフェニルキサンテート基を与えるという3つのステップからなる新しいチオエステル合成法を開発した(図14、A)[40]。得られたペプチド115をN-アセチルグアニジンで処理し、ペプチドチオエステルに変換できる誘導体116を得た。最後に、N-アセチルグアニジン誘導体116を目的のチオエステル117に変換することに成功した。この効率的な反応に加え、ペプチジルN-アセチルグアニジンは対応するチオエステルよりもNCLに対する反応性がはるかに低いので、ワンポット逐次NCLに直接使用できる。このチオエステル化を利用して、次の項目で紹介するインターロイキン13の半合成に成功した(図15)。
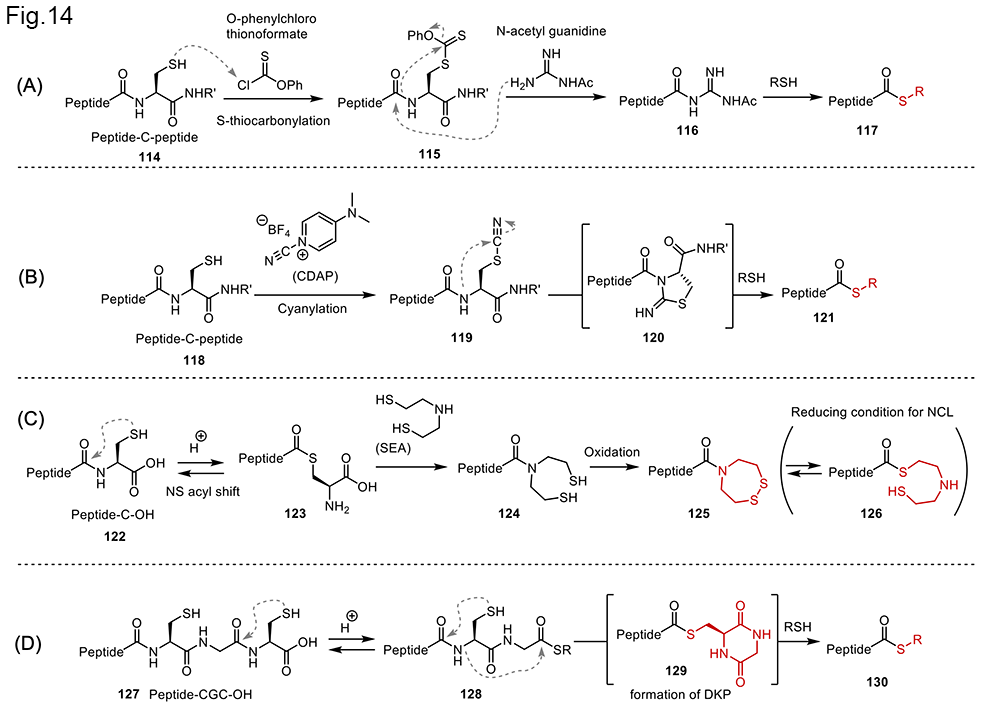
また、有機生物化学研究室ではCys残基のシアニル化を利用したチオエステル化法を開発した41(Fig14, B)。この反応では、まず、システイン残基のチオール基がシアニル化試薬によってシアニル化される。この中間体119は比較的安定であり、ヒドラジンやアミンのような求核剤の存在下で、システインのアミド窒素がシアニル基のsp炭素を求核的に攻撃し、5員環中間体が形成され、対応するペプチドヒドラジドがチオエステル代用体として効率よく得られる。この方法では、94個のアミノ酸からなるポリペプチドチオエステルを大腸菌で発現させ、シアニル化、ヒドラジノリシス、チオリシスによってポリペプチドチオエステルが得られることを示した。Cys残基を利用した発現ペプチドのチオエステル化の試みは、いくつかの糖タンパク質を合成することに利用できた。しかし、これらのCys残基によるチオエステル化プロトコールは、複数の反応工程を必要とした。また、ペプチドの中程に位置するシステインがある場合、C末端のCysを選択的に修飾することも困難であった。これらの問題を解決するために、当研究室では、2022年に化学選択性の高い2種類のペプチドのチオエステル化反応を発見した[42]。これらの新しいチオエステル化反応は、保護基を一切使用せず、C末端のCys残基で分子内N-Sアシルシフト反応を適用して進行する(図14, C,D)。基礎となる重要な反応は、Aimoto [43-44]およびMacmillan [45]グループが報告をしている。これら方法を組み合わせることで、簡便な方法を見出すことができた。 一つ目の方法は、ビス(2-スルファニルエチル)アミン(SEA)を用いたペプチド-Cys 122の化学変換で、ペプチド-SEA 125が効率よく得られ、ペプチドのチオエステルサロゲートとして利用できるというものである(図4-1, c) [42]。反応は、C末端Cysの分子内N-Sアシルシフトによるペプチド-Cys 122からペプチド-S-Cys-チオエステル123への変換から始まる。そして、ペプチド-S-Cys-チオエステル123をSEAのようなアルキルチオールを加えることで、チオエステル化し、ペプチド-SEA 124(ペプチドチオエステルサロゲート)を得る。この場合、SEAのチオールが反応後、アミノ基へ転移がおこり安定なアミド型になることがこの反応の平衡を生成物側に制御している。また、幸いなことに、ペプチド-SEA 124は空気中で酸化されてC末端にジスルフィド結合を形成し、ペプチド-S-Cys-チオエステル123には変換できないので、平衡状態はペプチド-SEA 125に偏っている。このペプチド-SEA 125はジスルフィド結合を切断し、チオールにすると平衡が126へと傾きチオエステルとなるため、そのままNCLに使うことができる。 2つ目の反応として、ペプチドのC末端にシステイニルグリシルシステイン127(ペプチド-CGC)を持つペプチドを利用し、ペプチドチオエステルを合成する方法も見いだした(図14、D)[42]。ペプチド-CGC 127は、CysでのN-Sアシルシフトを介して、C末端にCG-チオエステルユニット128を持つペプチドを通して、ペプチドチオエステル130に変換できる。次に、ペプチド-CG-チオエステル128は、ジケトピペラジン(DKP)形成とそれに続くCysでのN-Sアシルシフトを介して、ペプチドチオエステル130に変換できることを見出した。本有機生物化学研究室では、これら開発したCysベースのチオエステル化法をもとに、糖タンパク質の半合成の検討を開始した。